
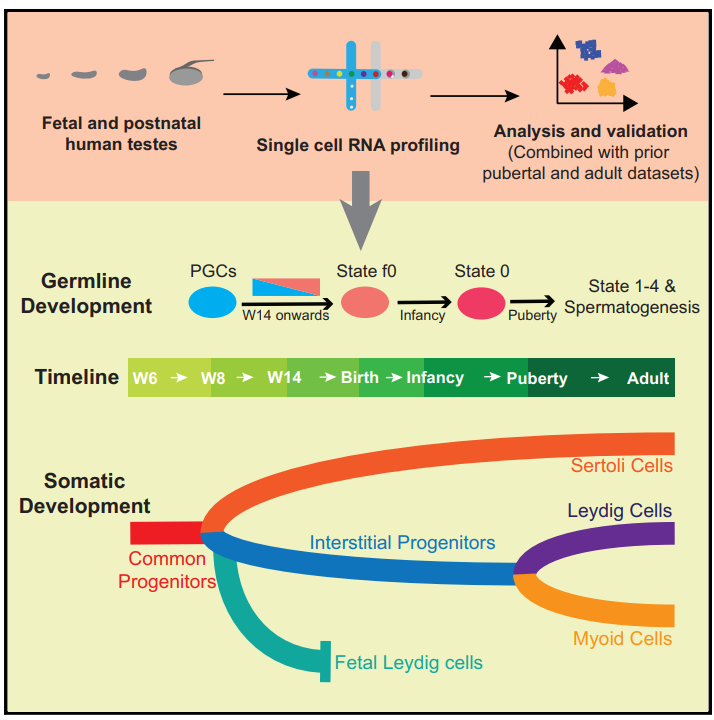
精原干细胞(SSCs)通过保持自我更新和分化的平衡维持持续的精子发生和生育能力。SSCs的发育过程始于胚胎,并持续到胎儿期、青春期及成年期。近年有研究表明,成男男性的精原细胞发育能够分成5种不同的细胞状态,其中最早的State 0 SSC可以追溯到刚出生的婴儿中。然而,在胚胎发育4~5周,原始生殖细胞(PGCs)已经出现,关于PGCs和SSCs之间的关系仍缺乏深入研究。在成人睾丸中,体细胞对雄性生殖系的维持和分化发挥着重要作用,这些体细胞主要包括支持细胞、间质细胞和肌样细胞,他们为SSCs到精子发生的过程提供适合的微环境。在青春期时,男性睾丸已经建立了功能性及管腔结构,所有的体细胞已经成熟。然而,在胚胎期,有些问题还尚不清楚,比如人类睾丸体细胞谱系最初的命运决定,以及是否存在共同的祖细胞等。
2021年1月15日,来自美国犹他大学医学院的郭靖涛实验室、Bradley Cairns实验室和加州大学洛杉矶分校Amander Clark实验室在Cell Stem Cell上发表了题为“Single-cell Analysis of the Developing Human Testis Reveals Somatic Niche Cell Specification and Fetal Germline Stem Cell Establishment”的论文,该研究利用单细胞测序揭示了人类睾丸在胚胎期和婴儿期的发育过程。研究人员从胚胎、胎儿和婴儿阶段得到了约32,500个睾丸细胞的单细胞转录组数据。分析结果显示,在受精后6-7周,随着睾丸索的建立,支持细胞和间质细胞起源于同一个的异质性祖细胞池。从受精后14-16周开始,雄性PGC退出有丝分裂,多能性转录因子发生下调,并转变为与最初在婴儿和成人睾丸中定义的State 0 SSC相似的细胞,研究人员将这些胎儿精原细胞称为“state f0”。本研究详细地描述了人类胚胎期生殖细胞和睾丸体细胞的发育过程。
一、人类胚胎和婴儿睾丸的单细胞转录组图谱
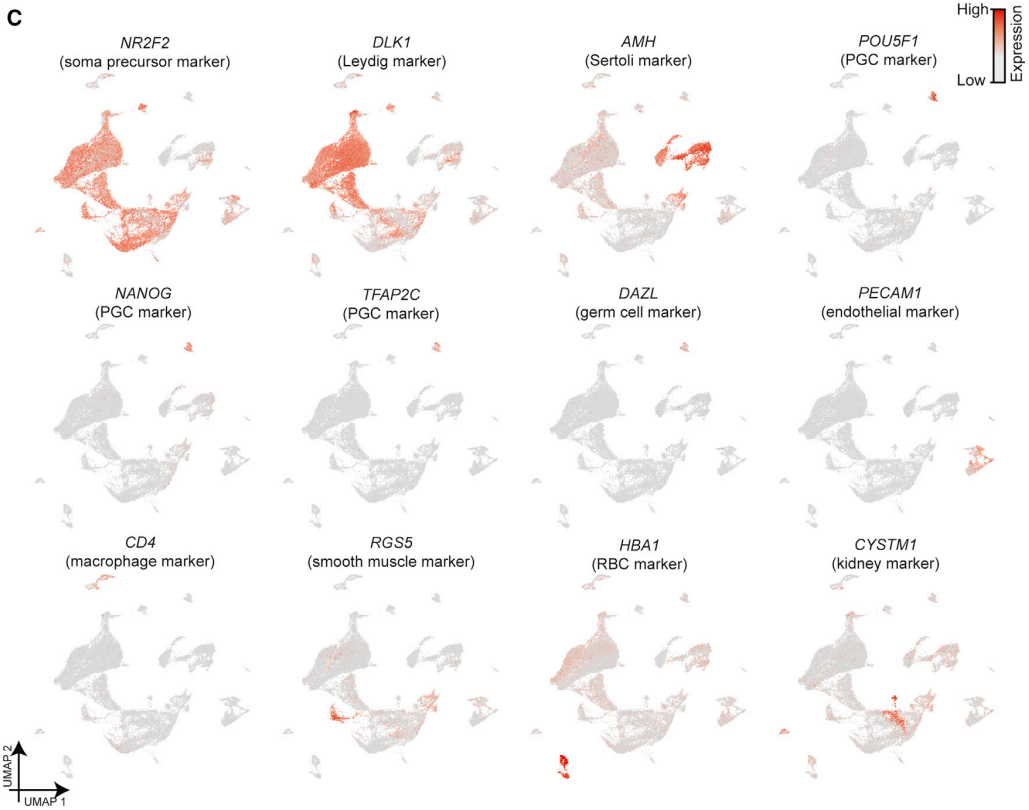
研究人员从3个胚胎阶段(受精后6、7和8周)、3个胎儿阶段(受精后12、15和16周)和1个婴儿阶段(出生后5个月)获得了人类睾丸组织,并与之前的数据集(婴儿、青少年和成人)进行比较。通过UMAP图谱,研究人员观察到6周和7周的细胞聚集成簇,而8、12、15和16周的细胞聚集成簇(图A)。聚类分析产生了17个主要的细胞群(图B),随后使用已知的Marker基因进行了注释(图C)。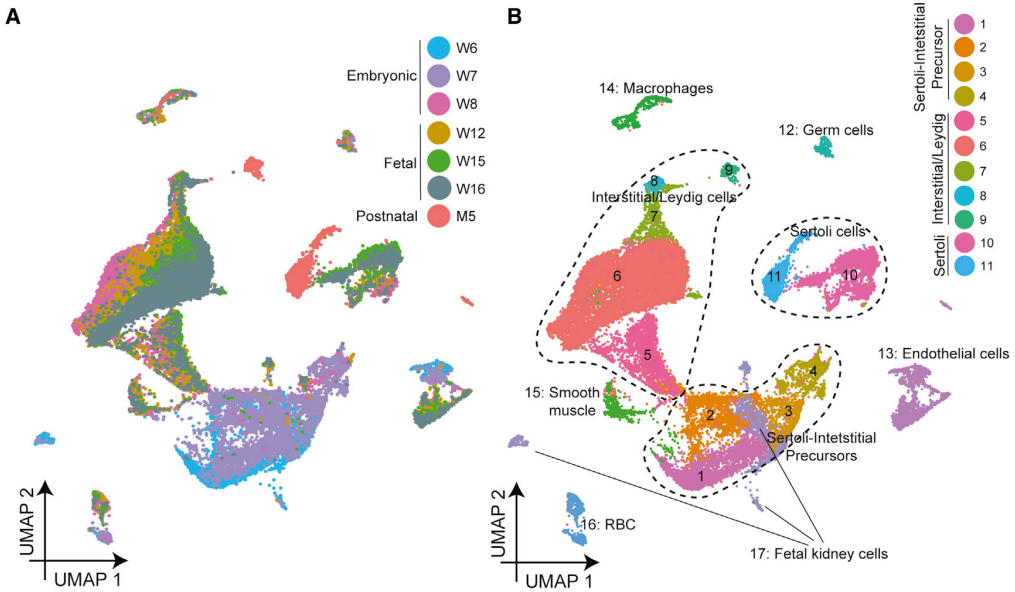
二、PGC 退出有丝分裂并抑制多能性后,state 0 SSC的出现
研究人员通过出生前后睾丸生殖细胞再分群来分析雄性生殖细胞的发育,并将这些数据与他们之前发表的婴儿生殖细胞(1岁)和成人精原细胞状态(state 0-4)的数据相结合进行比较。结果揭示了7个定义的细胞群和一个拟发育轨迹(图A)。按照拟时间顺序,研究人员观察到第1簇生殖细胞主要由6到12周的细胞以及第15周的一部分生殖细胞组成,被称为“胚胎-胎儿群”。它们的转录性质与PGCs一致,包括TFAP2C、KIT、NANOG、POUF51、SOX17的表达等(图B)。下一个发育阶段由来自15周和16周胎儿细胞与来自5个月和 1 岁出生后细胞组成,因此被称为“胎儿-婴儿群”。有趣的是,来自胎儿-婴儿群的细胞缺乏上述PGC标志物的表达,而是开始表达多个state 0 SSC的特异性Markers(PIWIL4、EGR4、MSL3、TSPAN33)。GO分析结果表明,胚胎-胎儿组 (PGC) 显示出与信号传导、性腺和干细胞发育相关的基因的高表达(图C)。然后在第 15 周至第 16 周之间突然被抑制,这与过渡到随后的胎儿-婴儿群相吻合。其中,胎儿-婴儿群中许多转录和同源框相关基因(簇2)的上调,以及state 0精原细胞标志物的上调。研究结果表明,存在于婴儿中的精原细胞(称为state 0与在PGC退出多能样状态后直接出现的胎儿生殖细胞高度相似。鉴于这种相似性,将这些胎儿(f)细胞称为state f0。
为了在蛋白质水平验证实验结果,研究人员对关键Markers进行了IF染色。从5周到19周,NANOG +(PGC 标记)和 MKI67 +(增殖标记)的比例持续减少(图D)。state 0 Marker在8周和10周样本中未检测到 PIWIL4 阳性。然而,从第 14 周开始,PIWIL4 +细胞能被明显的检测到(图E、F)。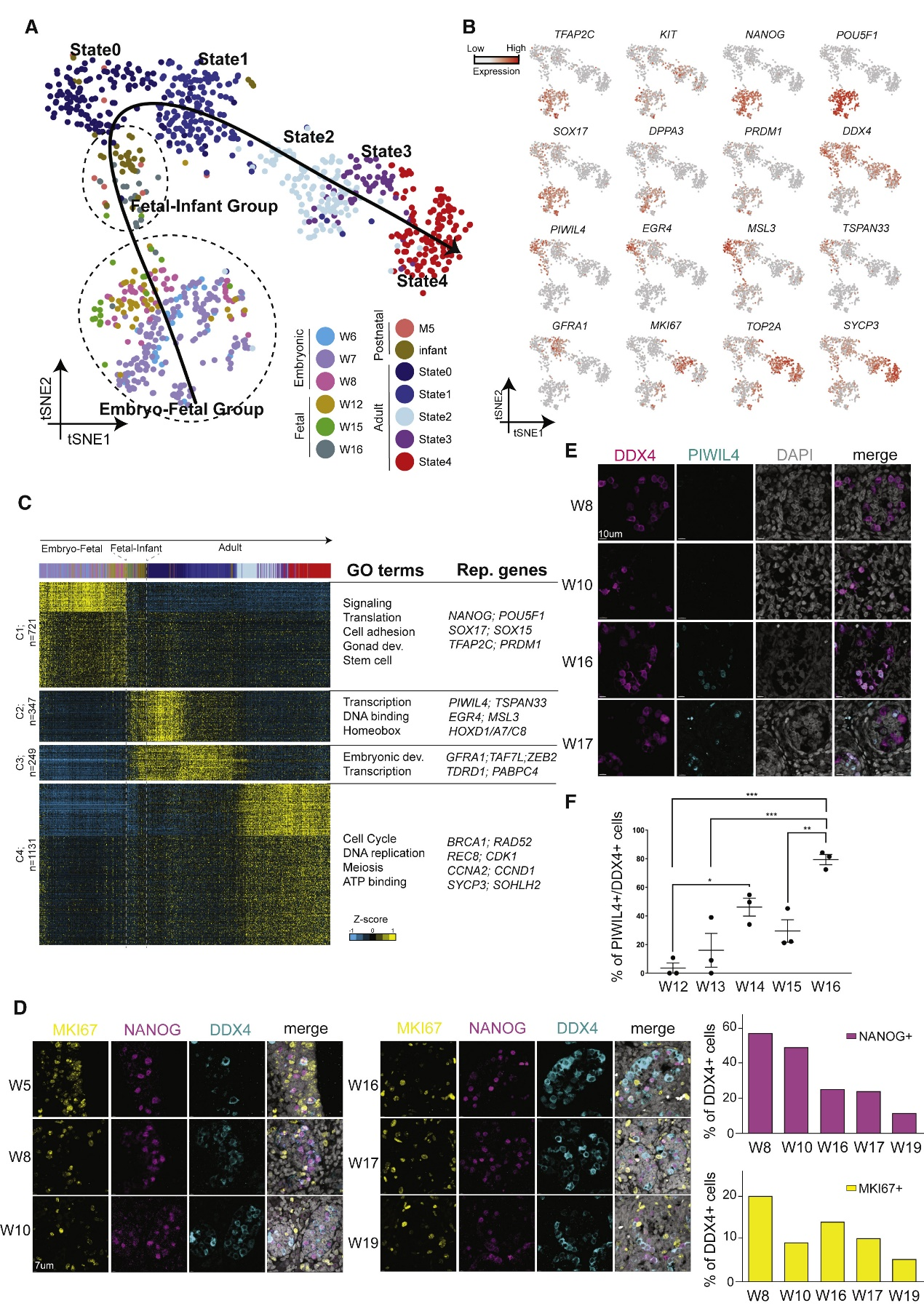
三、间质细胞与支持细胞的在胚胎期和胎儿期的发育谱系
研究人员为了进一步解析早期Leydig和Sertoli的发育谱系,通过重新聚类和拟时间分析发现在早期存在的一个细胞簇,在后期转录分叉成两个不同的谱系(图A)。早期细胞群仅由第6-7周的细胞组成,而从第7周开始的细胞沿着2条不同的路径排列(图A、B )。这 2 条发育路径分别代表支持细胞(左轨迹)和间质细胞(右轨迹)谱系(图C、D),并且在第6-7周存在一个异质细胞池,这是两条轨迹的起源,表明了其共同祖细胞种群的可能性。基于聚类分析结果,将胚胎-胎儿期的间质和支持细胞发育分为七个阶段 (A-G),并展示了相关Markers表达(图C、D、E)。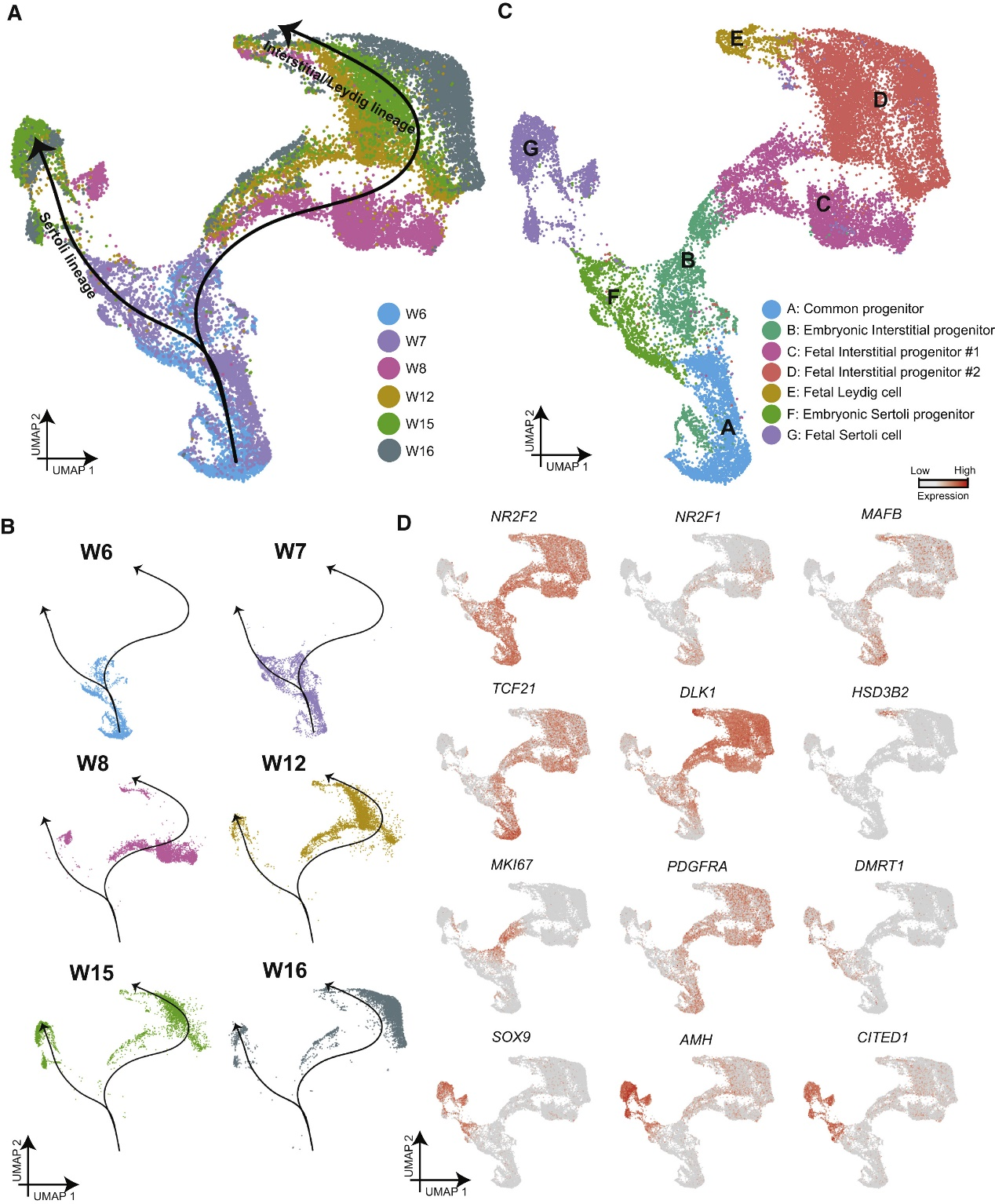
研究人员通过基因表达聚类分析来展示了沿着拟时间发育轨迹的动态基因集,进一步定义了与男性性别决定相关的基因表达模式。
四、在胚胎期与间质和支持细胞谱系相关的关键因素
晚期间质或支持细胞谱系特征的转录因子6周还未表达,7周开始出现,8至16周的睾丸中表达较高。为了更好地了解在体细胞发育阶段表达的基因,研究人员单独对6周和7周的细胞进行了更详细的解析。PCA显示,大部分细胞没有显示出间质细胞或支持细胞特有的标记(图A),表明出现了支持细胞和间质/间质前体的异质种群。根据基因表达模式(图B),将底部的细胞定义为胚胎期间质/间质前体谱系(表达DLK1和TCF21),将右上角的细胞指定为胚胎期支持细胞谱系(表达SRY,DMRT1、SOX9、AMH等)。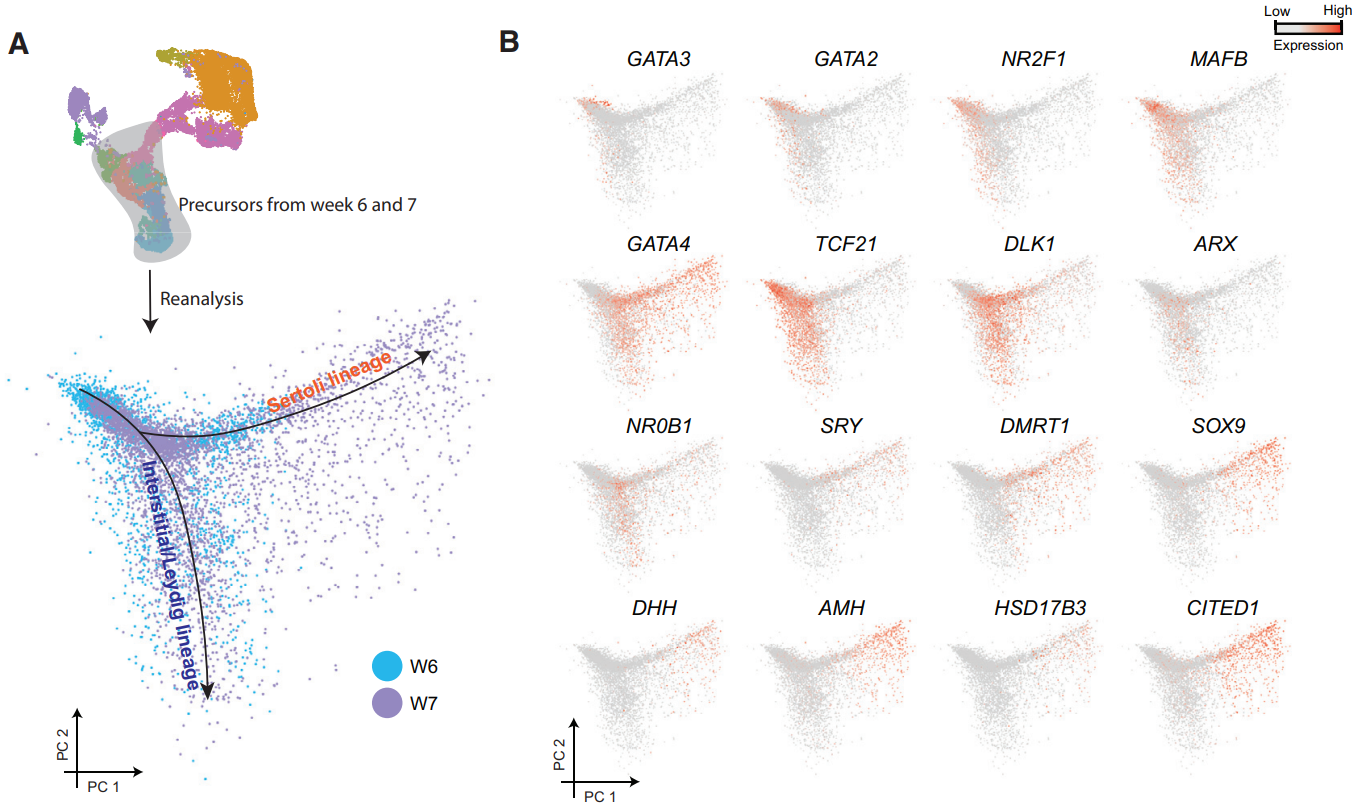
五、总结
睾丸为SSC提供体内环境而引导其分化产生配子,深入了解SSC的产生过程可以改善男性生殖健康。本研究为人类睾丸形成的时间及其在出生前后的发育过程提供了重要证据。其中,在胎儿期约15周出现的state f0 SSC与婴儿和成人期的state 0 SSC高度相似,从而能够将PGC与成人state 0细胞联系起来作为一个完整的发育进程。此外,研究人员还提供了体细胞祖细胞池的分子特征及其向体细胞的增殖和分化的过程,同时解析了其对睾丸索形成和指导生殖细胞发育中的作用。这些结果为未来的假设研究奠定了基础,也有助于指导人类早期睾丸的体外重建及相关研究。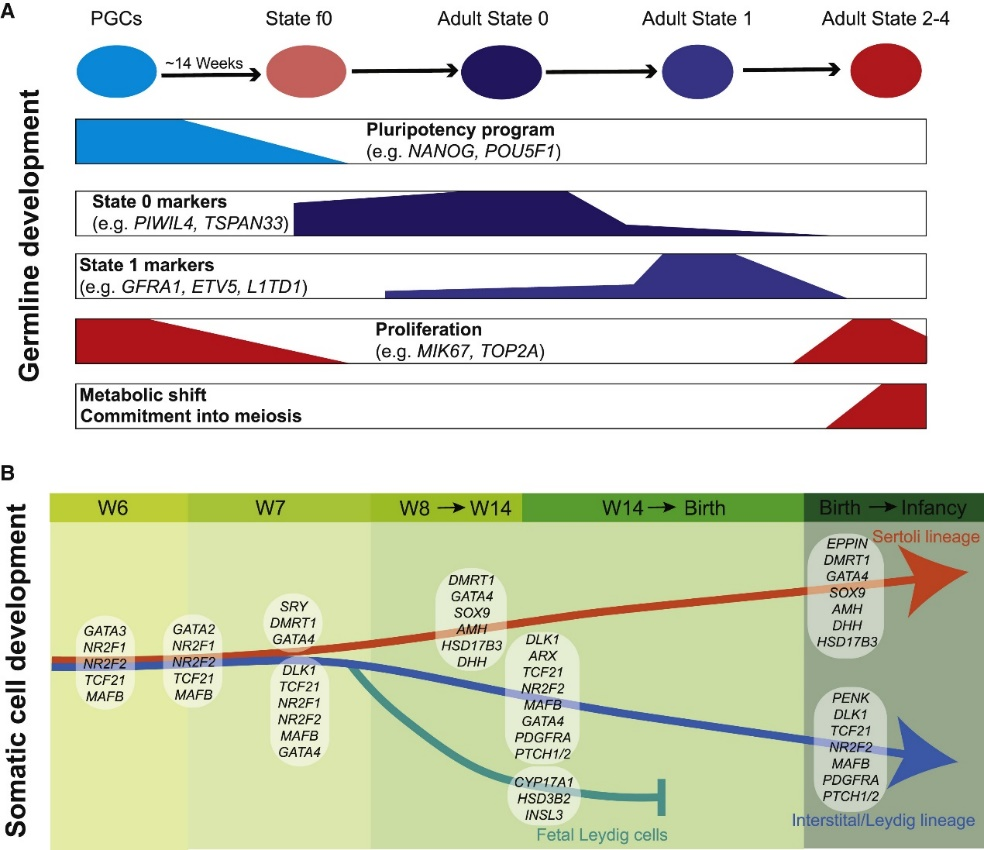
参考文献:Guo J, Sosa E, Chitiashvili T, et al. Single-cell analysis of the developing human testis reveals somatic niche cell specification and fetal germline stem cell establishment. Cell Stem Cell. 2021;28(4):764-778.e4. doi:10.1016/j.stem.2020.12.004
制版人:张博航